Как нейросети придумывают новые лекарства
Разработка нового лекарства — процесс долгий и дорогой. От первой идеи до появления препарата в аптеке проходит больше десяти лет, а стоимость такого пути исчисляется миллиардами долларов [1,9]. Из тысяч молекул, которые кажутся перспективными, до применения в медицине доходит лишь одна. Остальные отсеиваются: одни оказываются токсичными, другие неэффективными, третьи не выдерживают испытаний на людях.
Десятилетиями фармацевтика жила по этой модели. Ресурсы уходили впустую, а пациенты ждали новые препараты годами. Теперь у науки появился новый инструмент — искусственный интеллект. Нейросети помогают анализировать огромные массивы данных и находить закономерности, которые человек может пропустить.
Но могут ли такие технологии действительно ускорить разработку и снизить её стоимость? И главное, безопасно ли это для пациентов? Об этом мы и поговорим.
Почему разработка лекарств занимает так много времени
Создание лекарства — это длинный маршрут из десятков этапов. В среднем путь занимает 12–15 лет и обходится в $1–2,6 млрд [1, 9]. При этом до 95% кандидатов отбраковываются на разных стадиях.
Традиционный цикл выглядит так:
- Сначала исследователи выбирают мишень — белок или ген, связанный с болезнью;
- Затем ищут молекулу, которая сможет с этой мишенью взаимодействовать;
- Проводят доклинические испытания — на клетках (in vitro) и животных (in vivo);
- Переходят к клиническим фазам:
- Фаза I — проверка безопасности на небольшой группе людей,
- Фаза II — первые данные об эффективности,
- Фаза III — масштабные испытания на сотнях и тысячах пациентов;
- И только потом лекарство может быть зарегистрировано.
Каждый из этих шагов занимает годы, и большинство кандидатов «сходит с дистанции». Именно поэтому появление нового препарата — редкое событие, за которым стоят колоссальные ресурсы и усилия.
Почему ищут новые подходы
Классическая система разработки лекарств работает, но становится всё менее эффективной. Инвестиции растут, а число одобренных препаратов снижается — это называют «кризисом инноваций» [1].
Для фармацевтических компаний это означает высокие риски: можно вложить миллиарды и потерять их, если препарат не дойдёт до финала. Для пациентов — долгие годы ожидания новых средств от тяжёлых болезней.
Поэтому всё больше внимания обращают на методы, которые могут переломить ситуацию. Искусственный интеллект обещает сократить сроки, снизить стоимость и повысить точность поиска. А главное, открывает путь к новым классам молекул, которые ранее оставались вне поля зрения [1, 2].
Как ИИ меняет разработку лекарств
Нейросети не заменяют учёных, и точно не делают лекарства «по щелчку». Их сила в другом: они помогают разбирать огромные массивы данных, с которыми человеку в одиночку не справиться. Если раньше для анализа сотен тысяч молекул требовались годы, то теперь алгоритмы способны перебрать их за часы. Это не «готовый ответ», а скорее умный фильтр: он отбрасывает заведомо слабые варианты и оставляет те, что действительно стоит проверить.
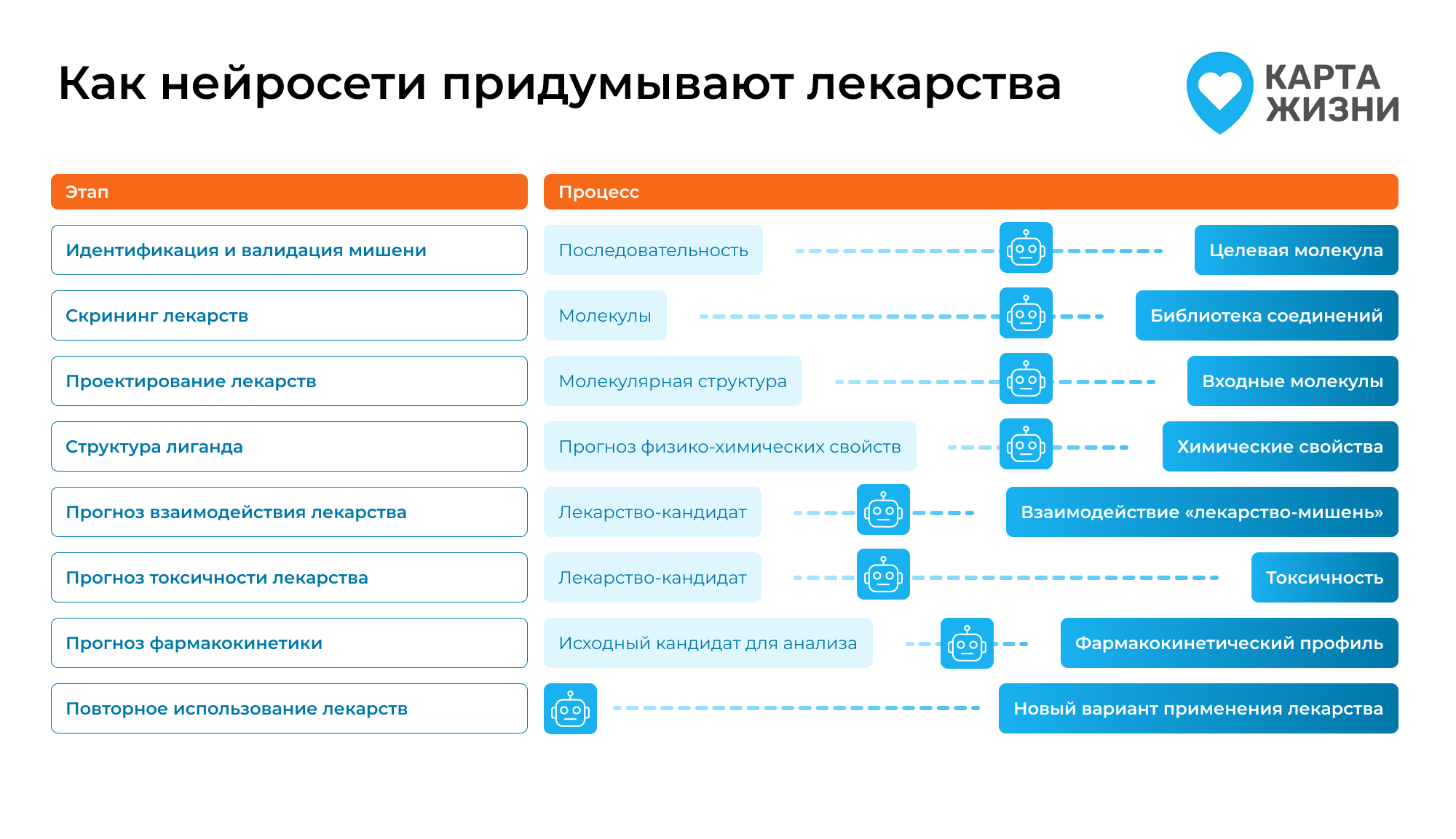
Где именно помогает ИИ
- Поиск мишеней Чтобы создать лекарство, нужно сначала понять, на что оно будет действовать — чаще всего это белок или ген. Нейросети помогают находить такие мишени, анализируя большие наборы биологических данных и выявляя связи с болезнью [3, 7].
- Создание молекул с нуля Классический подход — перебирать уже известные соединения. Генеративные модели предлагают новые химические структуры, которых раньше не существовало. Учёные задают условия, например, молекула должна связываться с определённым белком и быть безопасной, и получают набор кандидатов для проверки [1, 2].
- Докинг и предсказание взаимодействий Здесь проверяют, «подходит ли ключ к замку»: как молекула будет садиться в активный центр белка. Например, система Umol может строить такие прогнозы даже без готовой трёхмерной структуры белка [5].
- ADMET — полный путь лекарства в организме
Даже если молекула идеально связывается с мишенью, важно, что будет дальше:
- Absorption — как она всасывается,
- Distribution — как распределяется по органам,
- Metabolism — как разрушается и преобразуется (например, в печени),
- Excretion — как выводится,
- Toxicity — не окажется ли вредной. Вместе эти свойства описывают судьбу лекарства в организме. Проверка ADMET традиционно занимает годы, а нейросети помогают заранее отсеивать молекулы с плохими показателями [1, 9].
- Absorption — как она всасывается,
- Репозиционирование Иногда старые препараты неожиданно помогают при других болезнях. Алгоритмы находят такие связи, предлагая новое применение для уже известных средств [1, 7].
Примеры технологий
- ZINC-22 — библиотека из миллиардов молекул, доступных для синтеза; нейросети используют её для масштабного виртуального скрининга [4].
- Umol — алгоритм, предсказывающий, как молекула свяжется с белком даже без готовой 3D-структуры; это ускоряет поиск и экономит месяцы экспериментов [5].
- TranSiGen — система, которая анализирует профили активности генов в клетке, помогая находить лекарства там, где нет одной очевидной мишени [7].
- AlphaFold и аналоги — программы, которые предсказывают трёхмерную структуру белков по их генетической последовательности, что делает поиск мишеней и дизайн молекул более точным [1].
Реальные результаты
ИИ в медицине — это не только красивая теория. У нейросетей в медицине уже есть практические достижения. Некоторые из них пока проходят испытания, другие доказали эффективность на животных моделях. Но это уже реальные шаги, которые показывают, что технологии работают.
Лекарство против лёгочного фиброза
Одним из первых примеров стало лекарство под кодовым названием INS018_055. Оно было полностью разработано с помощью ИИ — от выбора мишени до создания самой молекулы. На этот процесс ушло около полутора лет вместо привычных четырёх — шести [2].
Сегодня препарат проходит фазу II клинических испытаний, то есть его уже проверяют на пациентах с идиопатическим лёгочным фиброзом — тяжёлым заболеванием, при котором лёгкие теряют способность нормально работать.
Новые антибиотики против супербактерий
Антибиотикорезистентность — одна из главных угроз медицины XXI века. Бактерии становятся устойчивыми к привычным препаратам, а новые классы антибиотиков почти не появлялись последние десятилетия.
Именно поэтому находка, сделанная с помощью deep learning в лаборатории Broad Institute, вызвала такой интерес. Алгоритм проанализировал миллионы молекул и нашёл новый структурный класс антибиотиков, активных против самых опасных супербактерий — MRSA и VRE [6].
Дальше были эксперименты на животных: препарат оказался эффективным и, что важно, безопасным. Более того, бактерии не смогли быстро выработать устойчивость к этому средству, что отличает его от большинства существующих антибиотиков.
Поиск средств против рака и нейровоспалений
Нейросети помогают и в борьбе с другими сложными болезнями. В одном исследовании алгоритм предложил молекулы против белка ROCK2, связанного с нейровоспалением. Один из кандидатов оказался эффективным в экспериментах на животных, снижая воспаление в нервной системе [3].
В другом случае модель TranSiGen проверила более 30 тысяч молекул для лечения рака поджелудочной железы и выделила десятки перспективных кандидатов. В лабораторных условиях многие из них действительно подавляли рост опухолевых клеток [7].
Вопрос безопасности
Когда речь заходит о лекарствах, главный вопрос всегда один: «А это точно безопасно?» Для технологий на основе нейросетей этот вопрос звучит особенно остро. Важно понимать, что новые методы не отменяют строгих правил проверки, а лишь помогают учёным работать быстрее.
Как проверяют лекарства, созданные с помощью ИИ
Даже если молекула была найдена с помощью алгоритма, она проходит тот же путь, что и любое другое лекарство. Сначала её тестируют in vitro — на клетках в лаборатории. Потом — in vivo, на животных. Лишь после этого начинается серия клинических фаз.
То, что молекулу «подсказал» ИИ, не даёт ей никаких поблажек. Проверка остаётся такой же строгой, и пройти её удаётся лишь немногим кандидатам [1, 9].
Что говорят регуляторы
Крупнейшие регуляторы уже внимательно следят за применением искусственного интеллекта. В США за это отвечает FDA. С 2016 по 2023 годы агентство получило более 500 заявок, связанных с использованием ИИ в разработке лекарств [8].
В 2025 году FDA выпустило проект руководства о том, как можно применять нейросети для поддержки решений о безопасности и эффективности препаратов. А внутри агентства создан специальный AI Council, который отвечает за координацию этой работы.
Ключевая позиция регулятора проста: ИИ может использоваться, если он помогает, но при этом процесс остаётся прозрачным и безопасным [8].
Ограничения и «чёрный ящик» нейросетей
У технологий есть и слабые стороны. Главная — зависимость от данных. Если данные неполные или искажённые, нейросеть будет делать неверные прогнозы. В медицине это особенно опасно [1, 9].
Другая проблема — так называемый «чёрный ящик». Иногда даже разработчики не могут до конца объяснить, почему алгоритм сделал тот или иной выбор. В случае с лекарствами это означает, что каждое предсказание всё равно требует проверки в лаборатории.
Что это значит для будущего медицины
Искусственный интеллект в разработке лекарств — это не чудо и не магия, а новый инструмент, который помогает учёным работать быстрее и точнее. Он не отменяет экспериментов и клинических испытаний, но способен заметно сократить путь от идеи до кандидата в препарат.
Уже есть первые примеры: молекулы, созданные с помощью нейросетей, проходят клинические испытания, а новые классы антибиотиков и соединений для лечения сложных заболеваний показали эффективность в лабораториях и на животных моделях. Но все они проходят тот же строгий путь проверки, что и традиционные лекарства.
Будущее медицины, скорее всего, будет сочетанием человеческого опыта и алгоритмов. Нейросети помогут находить перспективные идеи, а учёные будут проверять их и превращать в реальные лекарства. Для пациентов это означает одно: новые препараты смогут появляться быстрее и становиться доступнее, но контроль и наука по-прежнему остаются во главе процесса.
Источники
[1] Jarallah, A. I., et al. (2025). Artificial intelligence revolution in drug discovery: A paradigm shift in pharmaceutical innovation. International Journal of Pharmaceutics.
[2] Nature Biopharma Dealmakers. (2024, September). Generative AI platforms drive drug discovery dealmaking. Nature Biopharma Dealmakers, B3–B5.
[3] Chen, H., et al. (2024). Drug target prediction through deep learning functional representation of gene signatures. Nature Communications, 15(1):1853.
[4] Tingle, B. I., et al. (2023). ZINC-22 — A Free Multi-Billion-Scale Database of Tangible Compounds for Ligand Discovery. Journal of Chemical Information and Modeling, 63(4), 1166–1176.
[5] Bryant, P., et al. (2024). Structure prediction of protein-ligand complexes from sequence information with Umol. Nature Communications, 15:48837.
[6] Stokes, J. M., et al. (2024). Discovery of a structural class of antibiotics with explainable deep learning. Nature, 626, 336–343.
[7] Zhou, X., et al. (2024). Deep representation learning of chemical-induced transcriptional profile for phenotype-based drug discovery. Nature Communications, 15:49620.
[8] U.S. Food and Drug Administration (FDA), Center for Drug Evaluation and Research (CDER). (2025). Artificial Intelligence for Drug Development. FDA official guidance and resources.
[9] Klaus, B. (2023). AI Models and Drug Discovery Within Pharmaceutical Drug Market. Delaware Journal of Public Health, 94(9).
Номер одобрения: RU-26400
Дата одобрения: 21.10.2025
Дата истечения: 21.10.2027
МАТЕРИАЛ ПРЕДНАЗНАЧЕН ДЛЯ ШИРОКОЙ АУДИТОРИИ. ИНФОРМАЦИЯ, ПРЕДСТАВЛЕННАЯ В ДАННОМ РАЗДЕЛЕ, НЕ ПРЕДСТАВЛЯЕТ СОБОЙ И НЕ ЗАМЕНЯЕТ КОНСУЛЬТАЦИЮ ВРАЧА.
НЕОБХОДИМО ПОЛУЧИТЬ КОНСУЛЬТАЦИЮ ВРАЧА.
Сообщение о рекламации
Сообщение о нежелательном явлении
Служба медицинской информации
ООО «АстраЗенека Фармасьютикалз»
123112, город Москва, 1-й Красногвардейский проезд, дом 21, строение 1, этаж 30 Тел.: +7 (495) 799-56-99
© 2025 «AstraZeneсa». Все права защищены
Номер одобрения: RU-25463.
Дата одобрения: 21.07.2025.
Дата истечения: 21.07.2027. © 2025 «Карта Жизни»
Изображения задействованных моделей используются исключительно с целью иллюстрации и не свидетельствуют об одобрении ими деятельности или использовании ими продукции/услуги/ торговой марки.